contoh aplikasi kesetimbangan kimia dalam industri, menentukan dan
menghitung besarnya konstanta kesetimbangan kimia, mempelajari berbagai
jenis kesetimbangan kimia, memanipulasi persamaan kesetimbangan kimia,
serta mengkaji faktor-faktor yang dapat menggeser kesetimbangan kimia.
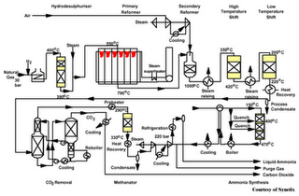
Salah satu proses yang sangat berguna dalam industri kimia adalah
proses Haber, yaitu sintesis gas amonia dari gas nitrogen dan gas
hidrogen. Reaksi kimia yang terjadi dalam proses Haber adalah sebagai
berikut :
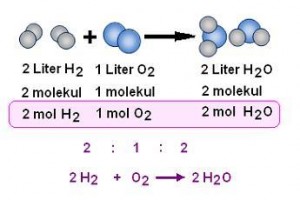
N2(g) + 3 H2(g) ——-> 2 NH3(g)
Dengan cara penulisan ini, reaksi kimia menunjukkan bahwa gas
hidrogen dan gas nitrogen bereaksi untuk menghasilkan gas amonia, dan
hal ini akan terus berlangsung sampai salah satu atau kedua reaktannya
habis. Tetapi, sesungguhnya, hal ini tidak sepenuhnya benar.
Apabila reaksi ini dilakukan dalam ruang tertutup (sebab reaktan
maupun gas sama-sama berbentuk gas), gas nitrogen dan gas hidrogen akan
bereaksi membentuk gas amonia. Namun, sebagian dari gas amonia tersebut
akan segera terurai menjadi gas nitrogen dan gas hidrogen kembali,
seperti yang ditunjukkan dalam persamaan reaksi berikut :
2 NH3(g) ——-> N2(g) + 3 H2(g)
Oleh sebab itu, di dalam ruang tertutup tersebut, sesungguhnya
terjadi dua reaksi yang saling berlawanan, yaitu gas nitrogen dan gas
hidrogen bergabung menghasilkan gas amonia dan gas amonia terurai
menghasilkan gas nitrogen dan gas hidrogen. Kedua reaksi tersebut dapat
dituliskan secara bersamaan dengan menggunakan dua mata anak panah
sebagai berikut :
N2(g) + 3 H2(g) <——> 2 NH3(g)
Gas nitrogen dan gas hidrogen diletakkan di sisi kiri karena bahan
itulah yang mula-mula dimasukkan ke dalam tempat reaksi. Kedua reaksi
tersebut terjadi dengan kecepatan yang berbeda. Namun, cepat atau
lambat, kecepatan kedua reaksi tersebut akan sama dan jumlah relatif
dari gas nitrogen, gas hidrogen, dan gas amonia menjadi tetap (konstan).
Ini merupakan contoh kesetimbangan kimia.
Kesetimbangan kimia dinamis tercapai pada saat dua reaksi kimia yang
berlawanan terjadi pada tempat dan waktu yang sama dengan laju reaksi
yang sama. Ketika sistem mencapai kesetimbangan, jumlah masing-masing
spesi kimia menjadi konstan (tidak perlu sama).
Kadang-kadang, terdapat banyak produk (spesi kimia yang ada di sisi
kanan tanda panah bolak-balik) ketika reaksi mencapai kesetimbangan.
Tetapi, kadang-kadang, produknya justru sangat sedikit. Jumlah relatif
dari produk dan reaktan dalam kesetimbangan dapat ditentukan dengan
menggunakan konstanta kesetimbangan kimia (K) untuk reaksi tersebut.
Secara umum, untuk reaksi kesetimbangan hipotetis berikut :
a A + b B <——> c C + d D
Huruf besar menunjukkan spesi kimia dalam kesetimbangan kimia dan
huruf kecil menyatakan koefisien reaksi pada reaksi kimia setara.
Konstanta kesetimbangan kimia (Keq) secara matematis dapat dinyatakan
dalam persamaan berikut :
Keq = [C ] c [D] d / [A] a [B] b
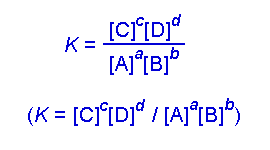
Persamaan Keq dirumuskan oleh dua ahli kimia berkebangsaan Norwegia,
yaitu Cato Guldberg dan Peter Waage, pada tahun 1864. Persamaan ini
merupakan pernyataan matematis dari hukum aksi massa (law of mass
action), yang menyatakan bahwa pada reaksi reversibel (bolak-balik, dua
arah) yang mencapai keadaan kesetimbangan pada temperatur tertentu,
perbandingan konsentrasi reaktan dan produk memiliki nilai tertentu
(konstan), yaitu Keq (konstanta kesetimbangan kimia).

Bagian pembilang mengandung produk dari kedua spesi kimia yang berada
di sisi kanan persamaan dengan masing-masing spesi kimia dipangkatkan
dengan koefisien reaksinya dalam persamaan reaksi berimbang. Penyebutnya
juga sama, tetapi digunakan spesi kimia yang berada di sebelah kiri
persamaan reaksi. Oleh karena satuan yang digunakan dalam konstanta
kesetimbangan kimia adalah konsentrasi (molaritas), para ahli kimia
menggunakan notasi Kc sebagai pengganti Keq.

Nilai angka dari konstanta kesetimbangan kimia memberikan petunjuk
tentang jumlah relatif dari produk dan reaktan. Nilai Kc juga memberikan
petunjuk apakah kesetimbangan cenderung ke arah reaktan atau produk.
Apabila nilai Kc jauh melebihi satu (Kc >> 1), kesetimbangan akan
cenderung ke kanan (produk), sehingga jumlah produk lebih besar
dibandingkan reaktan. Sebaliknya, apabila nilai Kc jauh di bawah satu
(Kc << 1), kesetimbangan akan cenderung ke kiri (reaktan),
sehingga jumlah reaktan lebih besar dibandingkan reaktan.
Konsep kesetimbangan kimia sangat berguna dalam ilmu kimia. Konstanta
kesetimbangan kimia digunakan dalam menyelesaikan berbagai permasalahan
stoikiometri yang melibatkan sistem kesetimbangan. Dalam menggunakan
Kc, konsentrasi reaktan dan produk saat kesetimbangan dilibatkan.
Berdasarkan fasa spesi kimia yang terlibat dalam reaksi, sistem
kesetimbangan dapat dibedakan menjadi dua, antara lain :
1. Kesetimbangan Homogen Semua spesi kimia berada dalam fasa yang
sama. Salah satu contoh kesetimbangan homogen fasa gas adalah sistem
kesetimbangan N2O4/NO2. Reaksi yang terjadi adalah sebagai berikut :
N2O4(g) <——> 2 NO2(g)
Kc = [NO2]2 / [N2O4]
Konsentrasi reaktan dan produk dalam reaksi gas dapat dinyatakan
dalam bentuk tekanan parsial masing-masing gas (ingat persamaan gas
ideal, PV=nRT). Dengan demikian, satuan konsentrasi yang diganti dengan
tekanan parsial gas akan mengubah persamaan Kc menjadi Kp sebagai
berikut :
Kp = (PNO2)2 / (PN2O4)
PNO2 dan PN2O4 adalah tekanan parsial masing-masing gas pada saat
kesetimbangan tercapai. Nilai Kp menunjukkan konstanta kesetimbangan
yang dinyatakan dalam satuan tekanan (atm). Kp hanya dimiliki oleh
sistem kesetimbangan yang melibatkan fasa gas saja.
Secara umum, nilai Kc tidak sama dengan nilai Kp, sebab besarnya
konsentrasi reaktan dan produk tidak sama dengan tekanan parsial
masing-masing gas saat kesetimbangan. Dengan demikian, terdapat hubungan
sederhana antara Kc dan Kp yang dapat dinyatakan dalam persamaan
matematis berikut :
Kp = Kc (RT)∆n
Kp = konstanta kesetimbangan tekanan parsial gas
Kc = konstanta kesetimbangan konsentrasi gas
R = konstanta universal gas ideal (0,0821 L.atm/mol.K)
T = temperatur reaksi (K)
∆n = Σ koefisien gas produk – Σ koefisien gas reaktan
Selain kesetimbangan homogen fasa gas, terdapat pula sejumlah
kesetimbangan homogen fasa larutan. Salah satu contoh kesetimbangan
homogen fasa larutan adalah kesetimbangan ionisasi asam asetat (asam
cuka) dalam air. Reaksi yang terjadi adalah sebagai berikut :
CH3COOH(aq) <——> CH3COO-(aq) + H+(aq)
Kc = [CH3COO-] [H+] / [CH3COOH]
2. Kesetimbangan Heterogen
Kesetimbangan ini melibatkan reaktan dan produk dalam fasa yang
berbeda. Sebagai contoh, saat padatan kalsium karbonat dipanaskan dalam
wadah tertutup, akan terjadi reaksi berikut :
CaCO3(s) <——> CaO(s) + CO2(g)
Dalam reaksi penguraian padatan kalsium karbonat, terdapat tiga fasa
yang berbeda, yaitu padatan kalsium karbonat, padatan kalsium oksida,
dan gas karbon dioksida. Dalam kesetimbangan kimia, konsentrasi padatan
dan cairan relatif konstan, sehingga tidak disertakan dalam persamaan
konstanta kesetimbangan kimia. Dengan demikian, persamaan konstanta
kesetimbangan reaksi penguraian padatan kalsium karbonat menjadi sebagai
berikut :
Kc = [CO2]
Kp = PCO2
Baik nilai Kc maupun Kp tidak dipengaruhi oleh jumlah CaCO3 dan CaO (jumlah padatan).
Beberapa aturan yang berlaku dalam penentuan nilai konstanta
kesetimbangan kimia saat reaksi kesetimbangan dimanipulasi (diubah)
antara lain :
1. Jika reaksi dapat dinyatakan dalam bentuk penjumlahan dua atau
lebih reaksi, nilai konstanta kesetimbangan reaksi keseluruhan adalah
hasil perkalian konstanta kesetimbangan masing-masing reaksi.
A + B <——> C + D Kc’
C + D <——> E + F Kc’’
A + B <——> E + F Kc = Kc’ x Kc’’
2. Jika reaksi ditulis dalam bentuk kebalikan dari reaksi semula,
nilai konstanta kesetimbangan menjadi kebalikan dari nilai konstanta
kesetimbangan semula.
A + B <——> C + D Kc’ = [C] [D] / [A] [B]
C + D <——> A + B Kc = [A] [B] / [C] [D] = 1 / Kc’
3. Jika suatu reaksi kesetimbangan dikalikan dengan faktor n, nilai
konstanta kesetimbangan menjadi nilai konstanta kesetimbangan semula
dipangkatkan dengan faktor n.
A + B <——> C + D Kc’ = [C] [D] / [A] [B]
2 A + 2 B D 2 C + 2 D Kc = [C]2 [D]2 / [A]2 [B]2 = { [C] [D] / [A] [B] }2 = (Kc’)2
Salah satu kegunaan konstanta kesetimbangan kimia adalah memprediksi
arah reaksi. Untuk mempelajari kecenderungan arah reaksi, digunakan
besaran Qc, yaitu hasil perkalian konsentrasi awal produk dibagi hasil
perkalian konsentrasi awal reaktan yang masing-masing dipangkatkan
dengan koefisien reaksinya. Jika nilai Qc dibandingkan dengan nilai Kc,
terdapat tiga kemungkinan hubungan yang terjadi, antara lain :
1. Qc < qc =” Kc”> Kc
Sistem reaksi reversibel kelebihan produk dan kekurangan reaktan. Untuk
mencapai kesetimbangan, sejumlah produk diubah menjadi reaktan.
Akibatnya, reaksi cenderung ke arah reaktan (ke kiri).
Kesetimbangan kimia dapat diganggu oleh beberapa faktor eksternal.
Sebagai contoh, pada pembahasan proses Haber sebelumnya, telah diketahui
bahwa nilai Kc pada proses Haber adalah 3,5.108 pada suhu kamar. Nilai
yang besar ini menunjukkan bahwa pada kesetimbangan, terdapat banyak gas
amonia yang dihasilkan dari gas nitrogen dan gas hidrogen. Akan tetapi,
masih ada gas nitrogen dan gas hidrogen yang tersisa pada
kesetimbangan. Dengan menerapkan prinsip ekonomi dalam dunia industri,
diharapkan sebanyak mungkin reaktan diubah menjadi produk dan reaksi
tersebut berlangsung sempurna. Untuk mendapatkan produk dalam jumlah
yang lebih banyak, kesetimbangan dapat dimanipulasi dengan menggunakan
prinsip Le Chatelier.
Seorang kimiawan berkebangsaan Perancis, Henri Le Chatelier,
menemukan bahwa jika reaksi kimia yang setimbang menerima perubahaan
keadaan (menerima aksi dari luar), reaksi tersebut akan menuju pada
kesetimbangan baru dengan suatu pergeseran tertentu untuk mengatasi
perubahan yang diterima (melakukan reaksi sebagai respon terhadap
perubahan yang diterima). Hal ini disebut Prinsip Le Chatelier.
Ada tiga faktor yang dapat mengubah kesetimbangan kimia, antara lain :
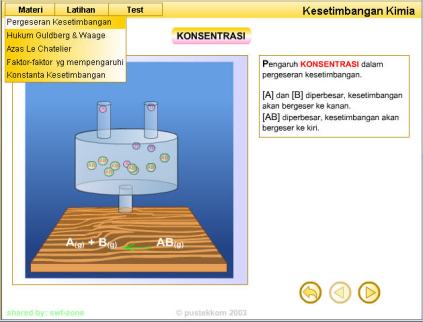
1. Konsentrasi reaktan atau produk
2. Suhu
3. Tekanan atau volume pada sistem yang mengandung fasa gas
Untuk memproduksi gas amonia sebanyak mungkin, dapat dilakukan
manipulasi kesetimbangan kimia dari segi konsentrasi reaktan maupun
produk, tekanan ruangan, volume ruangan, dan suhu reaksi. Berikut ini
adalah pembahasan mengenai masing-masing faktor.
1. Mengubah konsentrasi
Jika ke dalam sistem kesetimbangan ditambahkan gas nitrogen maupun
gas hidrogen berlebih (reaktan berlebih), nilai Qc menjadi lebih kecil
dibandingkan Kc. Untuk mengembalikan ke kondisi setimbang, reaksi akan
bergeser ke arah produk (ke kanan). Akibatnya, jumlah produk yang
terbentuk meningkat. Hal yang sama juga akan terjadi jika gas amonia
yang terbentuk langsung diambil. Reaksi akan bergeser ke arah kanan
untuk mencapai kembali kesetimbangan.
Dapat disimpulkan bahwa jika dalam sistem kesetimbangan ditambahkan
lebih banyak reaktan atau produk, reaksi akan bergeser ke sisi lain
untuk menghabiskannya. Sebaliknya, jika sebagian reaktan atau produk
diambil, reaksi akan bergeser ke sisinya untuk menggantikannya.
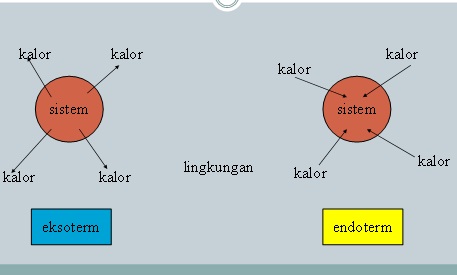
2.Mengubah suhu
Reaksi pada proses Haber adalah reaksi eksotermis. Reaksi tersebut dapat dinyatakan dalam persamaan reaksi berikut :
N2(g) + 3 H2(g) <——> 2 NH3(g) + Kalor
Jika campuran reaksi tersebut dipanaskan, akan terjadi peningkatan
jumlah kalor dalam sistem kesetimbangan. Untuk mengembalikan reaksi ke
kondisi setimbang, reaksi akan bergeser dari arah kanan ke kiri.
Akibatnya, jumlah reaktan akan meningkat disertai penurunan jumlah
produk. Tentu saja hal ini bukanlah sesuatu yang diharapkan. Agar jumlah
amonia yang terbentuk meningkat, campuran reaksi harus didinginkan.
Dengan demikian, jumlah kalor di sisi kanan akan berkurang sehingga
reaksi akan bergeser ke arah kanan.
Secara umum, memanaskan suatu reaksi menyebabkan reaksi tersebut
bergeser ke sisi endotermis. Sebaliknya, mendinginkan campuran reaksi
menyebabkan kesetimbangan bergeser ke sisi eksotermis.
3. Mengubah tekanan dan volume
Mengubah tekanan hanya mempengaruhi kesetimbangan bila terdapat
reaktan dan/atau produk yang berwujud gas. Pada proses Haber, semua
spesi adalah gas, sehingga tekanan dapat mempengaruhi kesetimbangan.
Reaksi pada proses Haber terjadi dalam ruangan tertutup. Tekanan pada
ruangan terjadi akibat tumbukan gas hidrogen, gas nitrogen, serta gas
amonia terhadap dinding ruangan tersebut. Saat sistem mencapai keadaan
setimbang, terdapat sejumlah gas nitrogen, gas hidrogen, dan gas amonia
dalam ruangan. Tekanan ruang dapat dinaikkan dengan membuat tempat
reaksinya menjadi lebih kecil (dengan memampatkannya, misal dengan
piston) atau dengan memasukkan suatu gas yang tidak reaktif, seperti gas
neon. Akibatnya, lebih banyak tumbukan akan terjadi pada dinding
ruangan bagian dalam, sehingga kesetimbangan terganggu. Untuk mengatasi
pengaruh tersebut dan memantapkan kembali kesetimbangan, tekanan harus
dikurangi.
Setiap kali terjadi reaksi maju (dari kiri ke kanan), empat molekul
gas (satu molekul gas nitrogen dan tiga molekul gas hidrogen) akan
membentuk dua molekul gas amonia. Reaksi ini mengurangi jumlah molekul
gas dalam ruangan. Sebaliknya, reaksi balik (dari kanan ke kiri),
digunakan dua molekul gas amonia untuk mendapatkan empat molekul gas
(satu molekul gas nitrogen dan tiga molekul gas hidrogen). Reaksi ini
menaikkan jumlah molekul gas dalam ruangan.
Kesetimbangan telah diganggu dengan peningkatan tekanan. Dengan
mengurangi tekanan, gangguan tersebut dapat dihilangkan. Mengurangi
jumlah molekul gas di dalam ruangan akan mengurangi tekanan (sebab
jumlah tumbukan akan berkurang). Oleh sebab itu, reaksi maju (dari kiri
ke kanan) lebih disukai, sebab empat molekul gas akan digunakan dan
hanya dua molekul gas yang akan terbentuk. Sebagai akibat dari reaksi
maju ini, akan dihasilkan gas amonia yang lebih banyak.
Secara umum, meningkatkan tekanan (mengurangi volume ruangan) pada
campuran yang setimbang menyebabkan reaksinya bergeser ke sisi yang
mengandung jumlah molekul gas yang paling sedikit. Sebaliknya,
menurunkan tekanan (memperbesar volume ruangan) pada campuran yang
setimbang menyebabkan reaksinya bergeser ke sisi yang mengandung jumlah
molekul gas yang paling banyak. Sementara untuk reaksi yang tidak
mengalami perubahan jumlah molekul gas (mol reaktan = mol produk),
faktor tekanan dan volume tidak mempengaruhi kesetimbangan kimia.
Katalis meningkatkan laju reaksi dengan mengubah mekanisme reaksi
agar melewati mekanisme dengan energi aktivasi terendah. Katalis tidak
dapat menggeser kesetimbangan kimia. Penambahan katalis hanya
mempercepat tercapainya keadaan setimbang.
Dari beberapa faktor di atas, hanya perubahan temperatur (suhu)
reaksi yang dapat mengubah nilai konstanta kesetimbangan (Kc maupun Kp).
Perubahan konsentrasi, tekanan, dan volume hanya mengubah konsentrasi
spesi kimia saat kesetimbangan, tidak mengubah nilai K. Katalis hanya
mempercepat tercapainya keadaan kesetimbangan, tidak dapat menggeser
kesetimbangan kimia.










 Pengaruh Volume / Tekanan dalam Pegeseran kesetimbangan
Pengaruh Volume / Tekanan dalam Pegeseran kesetimbangan Pengaruh suhu dalam pergeseran kimia
Pengaruh suhu dalam pergeseran kimia Van’t Hoff
Van’t Hoff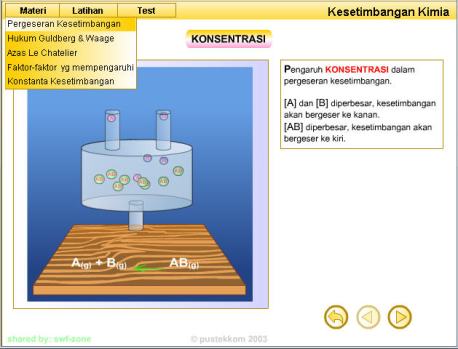


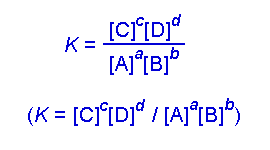


 … (1)
… (1)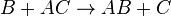 … (2)
… (2)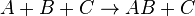

![\,v = k[A]^{n}[B]^{m}](http://upload.wikimedia.org/wikipedia/id/math/f/5/d/f5d1de7c967051b9e05efcf3c22ee195.png)


 ELEKTROFERESIS
ELEKTROFERESIS