Contoh paling sederhana dapat terlihat pada suatu lokus tunggal beralel ganda: alel yang dominan ditandai A dan yang resesif ditandai a. Kedua frekuensi alel tersebut ditandai p dan q secara berurutan; freq(A) = p; freq(a) = q; p + q = 1. Apabila populasi berada dalam kesetimbangan, maka freq(AA) = p2 untuk homozigot AA dalam populasi, freq(aa) = q2 untuk homozigot aa, dan freq(Aa) = 2pq untuk heterozigot.
Konsep ini juga dikenal dalam berbagai nama: Kesetimbangan Hardy-Weinberg, Teorema Hardy-Weinberg, ataupun Hukum Hardy-Weinberg. Asas ini dinamakan dari G. H. Hardy dan Wilhelm Weinberg.
Asas Hardy-Weinberg menyatakan bahwa frekuensi alel
dan frekuensi genotipe dalam suatu populasi akan tetap konstan, yakni
berada dalam kesetimbangan dari satu generasi ke generasi lainnya
kecuali apabila terdapat pengaruh-pengaruh tertentu yang mengganggu
kesetimbangan tersebut. Pengaruh-pengaruh tersebut meliputi perkawinan tak acak, mutasi, seleksi, ukuran populasi terbatas, hanyutan genetik, dan aliran gen.
Adalah penting untuk dimengerti bahwa di luar laboratorium, satu atau
lebih pengaruh ini akan selalu ada. Oleh karena itu, kesetimbangan
Hardy-Weinberg sangatlah tidak mungkin terjadi di alam. Kesetimbangan
genetik adalah suatu keadaan ideal yang dapat dijadikan sebagai garis
dasar untuk mengukur perubahan genetik.
Frekuensi alel yang statis dalam suatu populasi dari generasi ke
generasi mengasumsikan adanya perkawinan acak, tidak adanya mutasi,
tidak adanya migrasi ataupun emigrasi, populasi yang besarnya tak
terhingga, dan ketiadaan tekanan seleksi terhadap sifat-sifat tertentu.
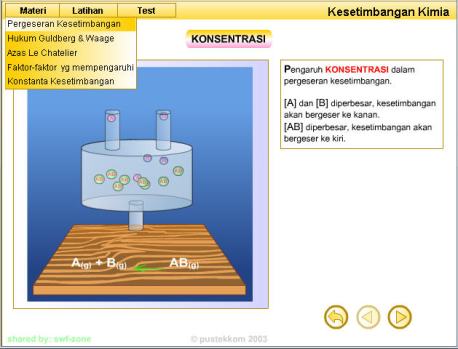
Hukum Guldberg dan Wange: Dalam keadaan kesetimbangan pada suhu
tetap, maka hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan
hasil kali konsentrasi pereaksi yang sisa dimana masing-masing
konsentrasi itu dipangkatkan dengan koefisien reaksinya adalah tetap.
Pernyataan tersebut juga dikenal sebagai hukum kesetimbangan.
Untuk reaksi kesetimbangan: a A + b B « c C + d D maka:
Kc = (C)c x (D)d / (A)a x (B)b
Kc adalah konstanta kesetimbangan yang harganya tetap selama suhu tetap.
BEBERAPA HAL YANG HARUS DIPERHATIKAN
-
Jika zat-zat terdapat dalam kesetimbangan berbentuk padat dan gas
yang dimasukkan dalam, persamaan kesetimbangan hanya zat-zat yang
berbentuk gas saja sebab konsentrasi zat padat adalah tetap den nilainya
telah terhitung dalam harga Kc itu.
Contoh: C(s) + CO2(g) « 2CO(g)
Kc = (CO)2 / (CO2)
-
Jika kesetimbangan antara zat padat dan larutan yang dimasukkan dalam perhitungan Kc hanya konsentrasi zat-zat yang larut saja.
Contoh: Zn(s) + Cu2+(aq) « Zn2+(aq) + Cu(s)
Kc = (Zn2+) / (CO2+)
-
Untuk kesetimbangan antara zat-zat dalam larutan jika pelarutnya
tergolong salah satu reaktan atau hasil reaksinya maka konsentrasi dari
pelarut itu tidak dimasukkan dalam perhitungan Kc.
Contoh: CH3COO-(aq) + H2O(l) « CH3COOH(aq) + OH-(aq)
Kc = (CH3COOH) x (OH-) / (CH3COO-)
Contoh soal:
1. Satu mol AB direaksikan dengan satu mol CD menurut persamaan reaksi:
AB(g) + CD(g) « AD(g) + BC(g)
Setelah kesetimbangan tercapai ternyata 3/4 mol senyawa CD berubah
menjadi AD dan BC. Kalau volume ruangan 1 liter, tentukan tetapan
kesetimbangan untuk reaksi ini !
Jawab:
Perhatikan reaksi kesetimbangan di atas jika ternyata CD berubah
(bereaksi) sebanyak 3/4 mol maka AB yang bereaksi juga 3/4 mol (karena
koefsiennya sama).
Dalam keadaan kesetimbangan:
(AD) = (BC) = 3/4 mol/l
(AB) sisa = (CD) sisa = 1 – 3/4 = 1/4 n mol/l
Kc = [(AD) x (BC)]/[(AB) x (CD)] = [(3/4) x (3/4)]/[(1/4) x (1/4)] = 9
2. Jika tetapan kesetimbangan untuk reaksi:
A(g) + 2B(g) « 4C(g)
sama dengan 0.25, maka berapakah besarnya tetapan kesetimbangan bagi reaksi:
2C(g) « 1/2A(g) + B(g)
Jawab:
- Untuk reaksi pertama: K1 = (C)4/[(A) x (B)2] = 0.25
- Untuk reaksi kedua : K2 = [(A)1/2 x (B)]/(C)2
- Hubungan antara K1 dan K2 dapat dinyatakan sebagai:
K1 = 1 / (K2)2 ® K2 = 2
belajar dan terus belajar ayo belajar kimia bersama
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
Label
- Eksponen Hidrogen (7)
- Gas Hidrogen (2)
- gas mulia (1)
- Hasil Kali Kelarutan (3)
- Hidrokarbon (9)
- Hitungan kimia (1)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
- Kimia lingkungan (1)
- Kimia Terapan Dan Terpakai (1)
- Larutan (2)
- Reaksi kimia (1)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistem Periodik Unsur-Unsur (1)
- Sistim koloid (4)
- Soal-soal kimia (1)
- Stoikiometri (4)
- Struktur Atom (5)
- Teori Asam-Basa Dan Stokiometri Larutan (2)
- Termokimia (4)
- Tokoh Penemu ilmu dan hukum kimia (1)
- Unsur-Unsur Alkali (3)
- Unsur-Unsur Alkali tanah (4)
- Unsur-unsur halogen (3)
- Unsur-Unsur Periode Ketiga (1)
- Unsur-Unsur Transisi Periode Keempat (4)
- Video (2)
- Zat Radioaktif (2)
Arsip Blog
-
▼
2011
(30)
-
▼
Desember
(30)
- Eksponen Hidrogen : Menyatakan pH Larutan Basa
- Eksponen hidrogen : Menyatakan pH Larutan Asam
- Kimia : Eksponen Hidrogen
- Larutan : Konsentrasi larutan
- Kimia : Penjelasan tentang larutan
- Kesetimbangan kimia : Kesetimbangan Disosiasi
- KESETIMBANGAN KIMIA : PENGARUH KATALISATOR TERHADA...
- Kesetimbangan kimia :Pergeseran kaesetimbangan
- Kesetimbangan kimia : Hukum kesetimbangan
- kesetimbangan kimia : Keadaan Kesetimbangan
- Kimia : Kesetimbangan kimia
- Kecepatan/Laju Reaksi : Faktor-Faktor Yang Mempeng...
- Kecepatan Reaksi : Tahap Menuju Kecepatan Reaksi
- Kecepatan reaksi : Teori Tumbukan Dan Teori Keadaa...
- Kecepatan reaksi : Orde Reaksi
- Konsentrasi Dan Kecepatan Reaksi
- Sistem koloid : Pembuatan Koloid
- Elektroferisis Dan Dialisis
- Sistem koloid : Sifat-Sifat Koloid
- Sistim koloid : Sistem Dispers Dan Sistem Koloid
- Energi dan ikatan kimia
- Penentuan Perubahan Entalpi Dan Hukum Hess
- Perubahan Entalpi
- Reaksi Eksoterm Dan Reaksi Endoterm
- Hitungan kimia
- Persamaan reaksi kimia
- Konsep mol dan pengertian molekul
- Massa Atom Dan Massa Rumus
- Hukum-Hukum Dasar Ilmu Kimia
- Jabir Ibnu Hayyan Adalah Penemu Ilmu Kimia
-
▼
Desember
(30)
-
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
-
-
Label
- Eksponen Hidrogen (7)
- Hidrokarbon (9)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- Larutan (2)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistim koloid (4)
- Stoikiometri (4)
- Struktur Atom (5)
- Termokimia (4)
- Unsur-Unsur Alkali tanah (4)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
Copyright © 2011 ILMU KIMIA | Powered by Blogger












0 komentar:
Posting Komentar