
Pada tahun 1808, Marie Francois Raoult
seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap
jenuh larutan, sehingga ia menyimpulkan tekanan uap jenuh larutan sama
dengan fraksi mol pelarut dikalikan dengan tekanan uap jenuh pelarut
murni[3]. Persamaan penurunan tekanan uap dapat ditulis[3]. Kesimpulan ini dikenal dengan Hukum Raoult dan dirumuskan dengan[3]. Persamaan penurunan tekanan uap dapat ditulis[3] :
P = P0 x Xp
ΔP = P0 x Xt
- Keterangan :
P0 = tekanan uap jenuh pelarut murni
Xp = fraksi mol zat pelarut
Xt = fraksi mol zat terlarut
Penurunan Tekanan Uap Jenuh
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van’t Hoff adalah[6] :ΔP =P0
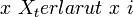
Kenaikan Titik Didih
Persamaannya adalah[6]:ΔTb=
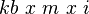
Penurunan Titik Beku
Persamaannya adalah[6] :ΔTf =
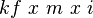
Tekanan Osmotik
Persamaannya adalah[6] :π =
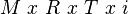
PENURUNAN TEKANAN UAP JENUH
Pada setiap suhu, zat cair selalu mempunyai tekanan tertentu. Tekanan ini adalah tekanan uap jenuhnya pada suhu tertentu. Penambahan suatu zat ke dalam zat cair menyebabkan penurunan tekanan uapnya. Hal ini disebabkan karena zat terlarut itu mengurangi bagian atau fraksi dari pelarut, sehingga kecepatan penguapanberkurang.
Menurut RAOULT:
p = po . XB
dimana:
p = tekanan uap jenuh larutan
po = tekanan uap jenuh pelarut murni
XB = fraksi mol pelarut
Karena XA + XB = 1, maka persamaan di atas dapat diperluas menjadi:
P = Po (1 – XA)
P = Po – Po . XA
Po – P = Po . XA
sehingga:
DP = po . XA
dimana:
DP = penunman tekanan uap jenuh pelarut
po = tekanan uap pelarut murni
XA = fraksi mol zat terlarut
Contoh:
Hitunglah penurunan tekanan uap jenuh air, bila 45 gram glukosa (Mr = 180) dilarutkan dalam 90 gram air !
Diketahui tekanan uap jenuh air murni pada 20oC adalah 18 mmHg.
Jawab:
mol glukosa = 45/180 = 0.25 mol
mol air = 90/18 = 5 mol
fraksi mol glukosa = 0.25/(0.25 + 5) = 0.048
Penurunan tekanan uap jenuh air:
DP = Po. XA = 18 x 0.048 = 0.864 mmHg
KENAIKAN TITIK DIDIH
Adanya penurunan tekanan uap jenuh mengakibatkan titik didih larutan lebih tinggi dari titik didih pelarut murni.
Untuk larutan non elektrolit kenaikan titik didih dinyatakan dengan:
DTb = m . Kb
dimana:
DTb = kenaikan titik didih (oC)
m = molalitas larutan
Kb = tetapan kenaikan titik didih molal
Karena : m = (W/Mr) . (1000/p) ; (W menyatakan massa zat terlarut)
Maka kenaikan titik didih larutan dapat dinyatakan sebagai:
DTb = (W/Mr) . (1000/p) . Kb
Apabila pelarutnya air dan tekanan udara 1 atm, maka titik didih larutan dinyatakan sebagai:
Tb = (100 + DTb)oC















0 komentar:
Posting Komentar