
|
A. Cara Industri
|
B. Cara Laboratorium
|
||||||
| 1. Elektrolisis air yang sedikit diasamkan
2H2O (l) ® 2H2 (g) + O2 (g) |
|
||||||
| 2. 3Fe(pijar) + 4H2O « Fe3O4 (s) + 4H2(g) |
|
||||||
| 3. 2C(pijar) + 2H2O (g) ® 2H2 (g) + 2CO (g) |
|
belajar dan terus belajar ayo belajar kimia bersama
Konsentrasi larutan menyatakan secara kuantitatif komposisi zat terlarut dan pelarut di dalam larutan. Konsentrasi umumnya dinyatakan dalam perbandingan jumlah zat terlarut dengan jumlah total zat dalam larutan, atau dalam perbandingan jumlah zat terlarut dengan jumlah pelarut.
Konsep pH pertama kali diperkenalkan oleh kimiawan Denmark Søren Peder Lauritz Sørensen pada tahun 1909. Tidaklah diketahui dengan pasti makna singkatan “p” pada “pH”.
Besarnya konsentrasi ion H+ dalam larutan disebut derajat keasaman. Untuk menyatakan derajat keasaman suatu larutan dipakai pengertian pH.
Secara sederhana alur perhitungan kimia dapat kita jabarkan dan disederhanakan dalam bagan 6.24 dibawah ini. Reaksi yang kita jadikan contoh adalah reaksi oksidasi dari senyawa Propana.
STOIKIOMETRI adalah cabang ilmu kimia yang mempelajari hubungan kuantitatif dari komposisi zat-zat kimia dan reaksi-reaksinya. 1. HUKUM KEKEKALAN MASSA = HUKUM LAVOISIER.

|
A. Cara Industri
|
B. Cara Laboratorium
|
||||||
| 1. Elektrolisis air yang sedikit diasamkan
2H2O (l) ® 2H2 (g) + O2 (g) |
|
||||||
| 2. 3Fe(pijar) + 4H2O « Fe3O4 (s) + 4H2(g) |
|
||||||
| 3. 2C(pijar) + 2H2O (g) ® 2H2 (g) + 2CO (g) |
|


|
Titik Didih (oC)
|
-252.6oC
|
|
Titik Lebur (oC)
|
-259.2oC
|
|
Dengan Halogen
|
H2 (g) + Cl2 (g) ® 2 HCl (g)
HCl (g) + air ® H+ (aq) + Cl- (aq)
|
|
Dengan Logam
Golongan Alkali
|
2 Na (s) + H2 (g) ® 2 Na+H- (s) + energi
Na+H- (s) + H2O ® NaOH (aq) + H2 (g)
|
|
Susunan Atom
|
1 proton + 1 elektron
|
|
Isotop
|
11H , 12H , 13H
|
|
Potensial Iobisasi (kJ/mol)
|
56.9 kJ/mol
|
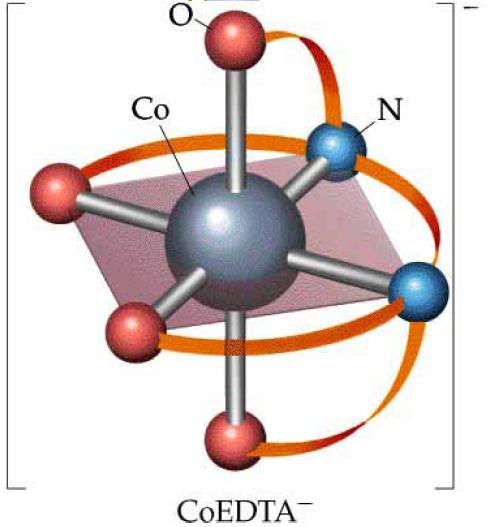

|
UNSUR
|
Oksida
|
Jenis oksida
|
Rumus Basa/Asam
|
|
24Cr
(krom) |
CrO
|
Oksida basa
|
Cr(OH)2
|
|
Cr2O3
|
Oksida amfoter
|
Cr(OH)3
HCrO2 |
|
|
CrO3
|
Oksida Asam
|
H2CrO4
H2CrO7 |
|
|
25Mn
(mangan) |
MnO
|
Oksida Basa
|
Mn(OH)2
|
|
Mn2O3
|
Mn(OH)3
|
||
|
MnO3
|
Oksida Asam
|
H2MnO4
HMnO4 |
|
|
Mn2O7
|
|||
|
26Fe
(besi) |
FeO
|
OKSIDA BASA
|
Fe(OH)2
|
|
Fe2O3
|
Fe(OH)3
|
||
|
27Co
(kobal) |
CoO
|
Co(OH)2
|
|
|
Co2O3
|
Co(OH)3
|
||
|
28Ni
(nikel) |
NiO
|
Ni(OH)2
|
|
|
Ni2O3
|
Ni(OH)3
|
||
|
29Cu
(tembaga) |
Cu2O
|
CuOH
|
|
|
CuO
|
Cu(OH)2
|
| UNSUR | 21Sc | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn |
| Konfigurasi Elektron | [Ar] 3d1 4s2 | [Ar] 3d2 4s2 | [Ar] 3d3 4s2 | [Ar] 3d5 4s1 | [Ar] 3d5 4s2 | [Ar] 3d6 4s2 | [Ar] 3d7 4s2 | [Ar] 3d8 4s2 | [Ar] 3d10 4s1 | [Ar] 3d10 4s2 |
| Massa jenis (g/mL) keelektro-negatifan |
Antara 3.4 – 8.92 (makin besar sesuai dengan arah panah)
——————————————————–> Antara 1.3 – 1.9 (makin besar sesuai dengan arah panah) |
|||||||||
| Bilangan oksidasi |
0;3
|
0;2; 3;4
|
0;2;3;
4;5 |
0;2; 3;6
|
0;2;3;
4;6;7 |
0;2;3
|
0;2;3
|
0;2;3
|
0;1;2
|
0;2
|
| Titik lebur (oC) |
Di atas 1000oC (berbentuk padat) | |||||||||
| Energi ionisasi (kJ/mol) | Antara 1872 – 2705 (sukar melepaskan elektron terluarnya) | |||||||||
| Jumlah elektron tunggal | Satu | Dua | Tiga | Enam | Lima | Empat | Tiga | Dua | Satu | - |
| Sifat para-magnetik/ fero-magnetik | Sifat yang disebabkan karena adanya elektron yang tidak berpasangan (=elektron tunggal) Makin banyak elektron tunggalnya, makin bersifat feromagnetik |
diama-gnetik | ||||||||
| Warna ion M2+ | - | - | Ungu | Biru | Merah muda | Hijau muda | Merah muda | Hijau | Biru | - |
| Warna ion M3+ | Tak ber-warna | Ungu | Hijau | Hijau | - | Kuning | - | - | - | - |
| Ion-ion tak berwarna |
Sc3+ , Ti4+ , Cu+ , Zn2+
|
|||||||||
|
Catatan : MnO4- = ungu Cr2O72- = jingga | ||||||||||
|
Unsur
|
Nomor Atom
|
Konfigurasi Elektron
|
Orbital
|
|||||||
| 3d | 4s | |||||||||
| Skandium (Sc) | 21 | (Ar) 3d1 4s2 |
|
|
||||||
| Titanium (Ti) | 22 | (Ar) 3d2 4s2 |
|
|
||||||
| Vanadium (V) | 23 | (Ar) 3d3 4s2 |
|
|
||||||
| Krom (Cr) | 24 | (Ar) 3d5 4s1 |
|
|
||||||
| Mangan (Mn) | 25 | (Ar) 3d5 4s2 |
|
|
||||||
| Besi (Fe) | 26 | (Ar) 3d6 4s2 |
|
|
||||||
| Kobalt (Co) | 27 | (Ar) 3d7 4s2 |
|
|
||||||
| Nikel (Ni) | 28 | (Ar) 3d8 4s2 |
|
|
||||||
| Tembaga (Cu) | 29 | (Ar) 3d10 4s1 |
|
|
||||||
| Seng (Zn) | 30 | (Ar) 3d10 4s2 |
|
|
||||||