Dalam bentuk molekul dikenal adanya teori
ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi
dengan cara saling bertindihan dari orbital-orbital atom. Elektron dalam
orbital yang tumpang tindih harus mempunyai bilangan kuantum spin yang
berlawanan.
Pertindihan antara dua sub kulit s tidak kuat, oleh karena distribusi
muatan yang berbentuk bola, oleh sebab itu pada umumnya ikatan s – s
relatif lemah.
Sub kulit “p” dapat bertindih dengan sub kulit “s” atau sub kulit “p”
lainnya, ikatannya relatif lebih kuat, hal ini dikarenakan sub kulit
“p” terkonsentrasi pada arah tertentu.
Contoh:
a. Molekul HF: - konfigurasi atom H : 1s1
- konfigurasi atom F: 1s2 2s2 2Px2 2py2 2pz1
Tumpang tindih terjadi antara sub kulit 1s dari atom H dengan orbital
2pz dari aton, F. Pertindihan demikian disebut pertindihan sp.
b. Molekul H2O: - konfigurasi atom H : 1s1
- konfigurasi atom O: 1s2 2s2 2Px2 2py1 2pz1
Dalam atom O terdapat 2 elektron dalam keadaan yang tidak berpasangan
(orbital 2py dan 2pz), masing-masing orbital ini akan bertindihan
dengan orbital 1s dari 2 atom H. Kedudukan orbital-orbital p saling
tegak lurus, diharapkan sudut ikatannya sebesar 90o, tetapi karena
adanya pengaruh pasangan elektron 2px, maka kedua ikatan tersebut akan
tertolak dan membentuk sebesar 104.5o.
c. Molekul CH4 - konfigurasi atom H: 1s1
- konfigurasi atom C: 1s2 2s2 2Px1 2py1 2pz0
Untuk mengikat 4 atom H menjadi CH4, maka 1 elektron dari orbital 2s
akan dipromosikan ke orbital 2pz, sehingga konfigurasi elektron atom C
menjadi: 1s1 2s1 2px1 2py1 2pz1 . Orbital 2s mempunyai bentuk yang
berbeda dengan ketiga orbital 2p, akan tetapi ternyata kedudukan keempat
ikatan C-H dalam CH4 adalah sama. Hal ini terjadi karena pada saat
orbital 2s, 2px, 2py dan 2pz menerima 4 elektron dari 4 atom H, keempat
orbital ini berubah bentuknya sedemikian sehingga mempunyai kedudukan
yang sama. Peristiwa ini disebut “hibridisasi”. Karena perubahan yang
terjadi adalah 1 orbital 2s dan 3 orbital 2p, maka disebut hibridisasi
sp3. Bentuk molekul dari ikatan hibrida sp3 adalah tetrahedron.
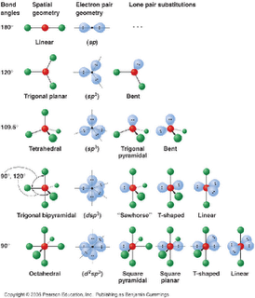
BEBERAPA BENTUK GEOMETRI IKATAN, ANTARA LAIN :
| Jenis ikatan | Jumlah ikatan maksimum | Bentuk geometrik |
| sp | 2 | Linier |
| sp2 | 3 | Segitiga datar |
| sp3 | 4 | Tetrahedron |
| dsp3 | 5 | Trigonal bipiramid |
| sp2d ; dsp2 | 4 | Segiempat datar |
| d2sp3 ; sp3d2 | 6 | Oktahedron |
1. Teori Domain Elektron
●Bentuk molekul tergantung pada susunan ruang pasangan elektron ikatan (PEI
dan pasangan elektron bebas (PEB) atom pusat dalam molekul. Dapat dijelaskan
dengan teori tolakan pasangan elektron kulit valensi atau teori VSEPR (Valence
Shell Electron Pair Repultion)
● Molekul kovalen terdapat pasangan-pasangan elektron baik PEI maupun PEB.
Karena pasangan-pasangan elektron mempunyai muatan sejenis, maka tolak-
menolak antarpasangan elektron. Tolakan (PEB – PEB) > tolakan (PEB – PEI) >
tolakan (PEI – PEI)
● Adanya gaya tolak-menolak menyebabkan atom-atom yang berikatan
membentuk struktur ruang yang tertentu dari suatu molekul dengan demikian
bentuk molekul dipengaruhi oleh banyaknya PEI maupun PEB yang dimiliki pada
atom pusat.
● Bentuk molekul ditentukan oleh pasangan elektron ikatannya
Contoh molekul CH4 memiliki 4 PEI
2. Merumuskan Tipe Molekul
1) Atom pusat dilambangkan dengan A
2) Domain elektron ikatan dilambangkan dengan X
3) Domain elektron bebas dinyatakan dengan E
Tabel tipe molekul
| Jumlah Pasangan Elektron Ikatan (X) | Jumlah Pasangan Elektron Bebas (E) | Rumus (AXnEm) | Bentuk Molekul | Contoh |
| 2 | 0 | AX2 | Linear | CO2 |
| 3 | 0 | AX3 | Trigonal planar | BCl3 |
| 2 | 1 | AX2E | Bengkok | SO2 |
| 4 | 0 | AX4 | Tetrahedron | CH4 |
| 3 | 1 | AX3E | Piramida trigonal | NH3 |
| 2 | 2 | AX2E2 | Planar bentuk V | H2O |
| 5 | 0 | AX5 | Bipiramida trigonal | PCl5 |
| 4 | 1 | AX4E | Bipiramida trigonal | SF4 |
| 3 | 2 | AX3E2 | Planar bentuk T | IF3 |
| 2 | 3 | AX2E3 | Linear | XeF2 |
| 6 | 0 | AX6 | Oktahedron | SF6 |
| 5 | 1 | AX5E | Piramida sisiempat | IF5 |
| 4 | 2 | AX4E2 | Sisiempat datar | XeF4 |
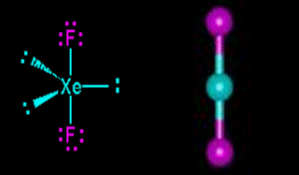
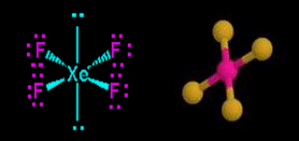
Pertama kita harus mementukan struktur lewis masing-masing molekul. Xe memiliki jumlah elektron valensi 8 sedangkan F elektron valensinya adalah 7.(lihat gambar dibawah)
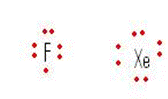
Struktur Lewis XeF2 seperti gambar sebelah kiri, dua elektron Xe masing-masing diapakai untuk berikatan secara kovalen dengan 2 atom F sehingga meninggalkan 3 pasangan elektron bebas pada atom pusat Xe. Hal yang sama terjadi pada molekul XeF4 dimana 4 elektron Xe dipakai untuk berikatan dengan 4 elektron dari 4 atom F, sehingga meninggalkan 2 pasangan elektron bebas pada atom pusat Xe.
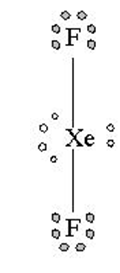
Lihat gambar diatas XeF2 memiliki 2 pasangan elekktron terikat (PET) dan 3 pasangan elektron bebas (PEB) jadi total ada 5 pasangan elektron yang terdapat pada XeF2, hal ini menandakan bahwa geometri molekul atau kerangka dasar molekul XeF2 adalah trigonal bipiramid. Karena terdapat 3 PEB maka PEB ini masing masing akan menempati posisi ekuatorial pada kerangka trigonal bipiramid, sedangkan PET akan menempati posisi aksial yaitu pada bagian atas dan bawah. Posisi inilah posisi yang stabil apabila terdapat atom dengan 2 PET dan 3 PEB sehingga menghasilkan bentuk molekul linear. Jadi bentul molekul XeF2 adalah linier.(lihat gambar dibawah).
Lihat gambar strutur lewis XeF4 memiliki 4 pasangan elekktron terikat (PET) dan 2 pasangan elektron bebas (PEB) jadi total ada 6 pasangan elektron yang terdapat pada XeF4, hal ini menandakan bahwa geometri molekul atau kerangka dasar molekul XeF4 adalah oktahedral. Karena terdapat 2 PEB maka PEB ini masing masing akan menempati posisi aksial pada kerangka oktahedral, sedangkan PET akan menempati posisi ekuatorial. Posisi inilah posisi yang stabil apabila terdapat atom dengan 4 PET dan 2 PEB sehingga menghasilkan bentuk molekul yang disebut segiempat planar. Jadi bentul molekul XeF2 adalah segiempat planar.(lihat gambar
dibawah).
Bentuk molekul akan sama dengan susunan ruang elektron yang ada pada atom pusat jika tidak pasangan elektron bebas.
Perhatikan gambar berbagai bentuk molekul berikut ini !
X : atom pusat
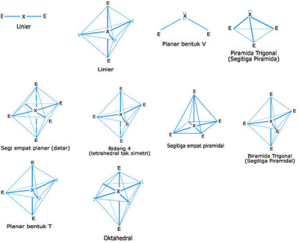
E : pasangan elektron bebas















0 komentar:
Posting Komentar