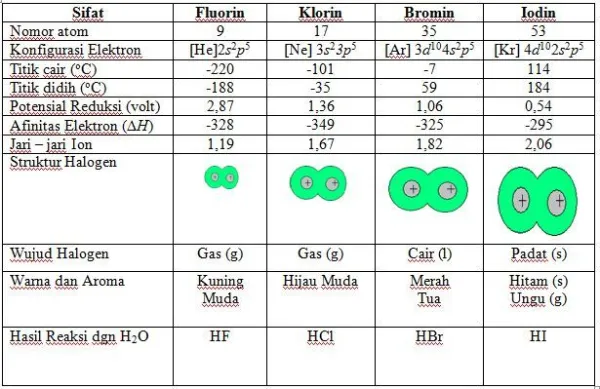
Sifat Fisis
|
UNSUR
|
Fluor
|
Klor
|
Brom
|
Iodium
|
Catatan :
|
||||||
|
9F
|
17Cl
|
35Br
|
53I
|
||||||||
| 1. Konfigurasi elektron |
[X] ns2 , np5
|
||||||||||
| 2. Massa Atom |
 |
||||||||||
| 3. Jari-jari Atom | |||||||||||
| 4. Energi Ionisasi dan Afinitas Elektron |
 |
||||||||||
| 5. Keelektronegatifan | |||||||||||
| 6. Potensial Reduksi (Eored > 0) | |||||||||||
| 7. Suhu Lebur (0o) |
-216.6
|
-101.0
|
-72
|
114.0
|
|||||||
| 8. Suhu Didih (0o) |
-188.2
|
-34
|
58
|
183
|
|||||||
| 9. Bilangan Oksidasi Senyawa Halogen |
-1
|
+ 1, +3 +5, +7 |
+ 1
+5, +7 |
+1 +5, +7 | |||||||
Sifat Kimia
Kereaktifan Halogen
F(g) + e F-(g) -> H = -328 kJ
Cl(g) + e Cl-(g) -> H = -349 kJ
Pada reaksi diatas kita dapat melihat, bahwa afinitas electron unsur halogen berkurang dari atas ke bawah, yaitu klorin ke iodine. Hal itu terjadi karena bertambahnya jari – jari atom, akan tetapi H (energi) fluorin lebih rendah dibandingkan klorin, penyimpangan ini terjadi karena kecilnya atom fluorin , yang membuat gaya tolak menolak antar electron.
Reaksi – reaksi pada Halogen
Halogen adalah unsur yang sangat reaktif. Unsur halogen dapat bereaksi dengan semua unsur, bahkan gas muia. Bahkan, zat yang tahan api seperti, air dan asbes dapat terbakar dalam gas fluorin.
a. Reaksi dengan logam
b. Reaksi dengan Hidrogen
c. Reaksi dengan nonlogam
d. Reaksi dengan hidrokarbon
e. Reaksi dengan air
f. Reaksi dengan basa
g. Reaksi antar halogen
Daya Oksidasi Halogen
Eo F2 = +2,87 v
Eo Cl2 = +1,36 v
Eo Br2 = +1,06 v
Eo I2 = +0,54 v
Reaksi pendesakan Halogen
F2 > Cl2 > Br2 > I2













0 komentar:
Posting Komentar