Atom
karbon dapat mernbentuk empat ikatan kovalen, Atom karbon dengan nomor
atom 6 mempunyai susunan elektron K = 2, L = 4, jadi mempunyai 4
elektron valensi. serta dapat digambarkan dengan rumus Lewis sebagai
berikut, umpamanya untuk CH4.
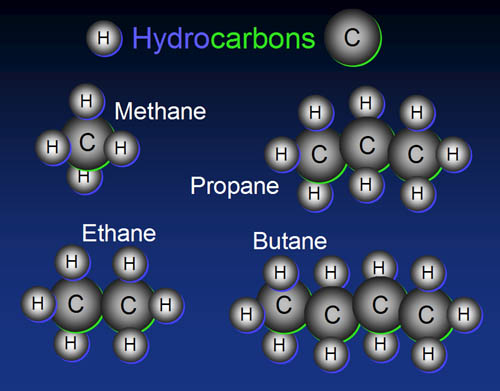
Kekhasan Atom karbon
Atom karbon (C) dengan nomor atom 6 mempunyai susunan elektron K = 2,
L = 4. C mempunyai 4 elektron valensi dan dapat mernbentuk empat ikatan
kovalen serta dapat digambarkan dengan rumus Lewis. Sebagai contoh,
dapat dilihat molekul CH4 (metana) yang memiliki diagram yang cukup
sederhana dibawah ini.
Selain itu kemampuan diatas, atom karbon juga dapat membentuk ikatan
dengan atom karbon lain untuk membentuk rantai karbon yang terbuka,
terbuka bercabang dan tertutup. Contoh rantai karbon dapat digambarkan
dengan rumus struktur berikut :
Dapatlah sekarang dimengerti bahwa jumlah senyawa karbon demikian banyaknya walaupun jumlah jenis unsur pembentuknya sedikit.
Kini kita dapat mulai membuat klasifikasi hidrokarbon, yang merupakan
senyawa yang hanya tersusun oleh karbon dan hidrogen. Senyawa-senyawa
karbon lainnya dapat dipandang sebagai turunan dari hidrokarbon ini.
Hidrokarbon dapat dibagi menjadi dua kelompok utama : hidrokarbon
alifatik dan hidrokarbon aromatik. Termasuk di kelompok pertama adalah
senyawa yang berantai lurus, berantai cabang dan rantai melingkar.
Kelompok kedua, hidrokarbon aromatik, biasanya mengandung cincin atom
karbon yang sangat stabil. Berdasarkan kelipatan ikatan
karbon-karbonnya, hidrokarbon alifatik masih dapat dibedakan lagi
menjadi dua sub-kelompok, yakni hidrokarbon jenuh yang mengandung ikatan
tunggal karbon-karbon, serta hidrokarbon tak jenuh yang mengandung
paling sedikit satu ikatan rangkap dua, atau ikatan rangkap tiga.
Karena senyawa hidro karbon terdiri atas karbon dan hidrogen, maka
salah satu bagian dari ilmu kimia yang membahas segala sesuatu tentang
senyawa hidrokarbon disebut kimia karbon. Dulu ilmu kimia karbon
disebut kimia organik, karena senyawa-senyawanya dianggap hanya dapat
diperoleh dari tubuh makhluk hidup dan tidak dapat disintesis dalam
pabrik.
Pada tahun 1928, Friedrich Wohler berhasil mensintesis urea (suatu
senyawa yang terdapat dalam air seni) dari senyawa anorganik yaitu
amonium sianat – dengan jalan memanaskannya.
Reaksi pemanasan amonium sianat oleh Wohler
Setelah keberhasilan Wohler diketahui, banyaklah sarjana lain yang
mencoba membuat senyawa karbon dari senyawa anorganik. Lambat laun teori
tentang arti hidup hilang dan orang hanya menggunakan kimia organik
sebagai nama saja tanpa disesuaikan dengan arti yang sesungguhnya. Sejak
saat itu banyak senyawa karbon berhasil disintesis dan hingga sekarang
lebih dari 2 juta senyawa karbon dikenal orang dan terus bertambah
setiap harinya. Apa sebabnya jumlah senyawa karbon sedemikian banyak
bila dibandingkan dengan jumlah senyawa anorganik yang hanya sekitar
seratus ribuan?
Selain perbedaan jumlah yang sangat mencolok yang menyebabkan kimia
karbon dibicarakan secara tersendiri, karena memang terdapat perbedaan
yang sangat besar antara senyawa karbon dan senyawa anorganik seperti
yang dituliskan pada tabel berikut.
Hidrokarbon adalah sejenis senyawa yang banyak terdapat dialam
sebagai minyak bumi. Indonesia banyak menghasilkan senyawa ini dalam
bentuk minyak bumi yang mempunyai nilai ekonomi tinggi.
Senyawa hidrokarbon terdiri dari :
- Alkana (CnH2n+2)
- Alkena (CnH2n)
- Alkuna (CnH2n-2)















0 komentar:
Posting Komentar