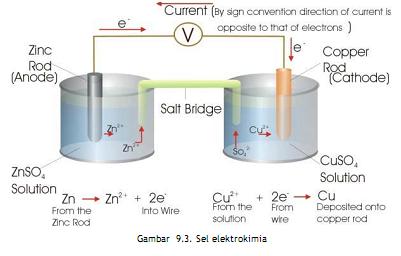
Sel volta terdiri atas elektroda tempat
berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan
tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Sel Volta adalah sel elektrokimia yang melibatkan raksi redoks dan menghasilkan arus listrik.
Susunan sel volta adalah :

Notasi sel : Y / ion Y // ion X / X
Logam X mempunyai potensial reduksi yang lebih positip dibanding
logam Y , sehingga logam Y bertindak sebagai anoda dan logam X bertindak
sebagai katoda.
Jembatan garam mengandung ion-ion positif dan ion-ion negative yang
berfungsi menetralkan muatan positif dan negative dalam larutan
elektrolit.
Contoh:
1. Gambarkan rangkaian sel volta yang terdiri atas elektroda magnesium dan seng, jika potensial electrode Mg2+/Mg = – 2,38 volt , Zn2+/ Zn = – 0,76 volt.
Jawab :
Gambar sel Volta elektroda Mg dan Zn

Penjelasan : potensial reduksi logam magnesium lebih negative dari
potensial reduksi logam zeng, sehingga logam magnesium bertindak sebagai
anoda dan logam seng bertindak sebagai katoda.
Beda potensial Sel dirumuskan :
1. Untuk keadaan standar dengan konsentrasi larutan 1 molar
Eosel = Ekatoda – E anoda
2. Untuk keadaan standar dengan konmsentrasi larutan tidak 1 molar

n = jumlah electron
Contoh :
Hitunglah beda potensial sel reaksi redok berikut :
a. Zn / Zn2+ // Ag+ / Ag
b. Zn / Zn2+ 0,2 M // Cu2+ 0,1 M // Cu
Jawab:
a). Gunakan rumus :
Eosel = Ekatoda – E anoda
= + 0,80 – ( – 0,76) = + 1,56 volt
b). Gunakan rumus :
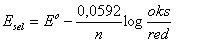
= +0,34 – ( – 0,76 ) + (0,059/2) log 0,2 / 0,1
= + 1,4285 volt
KONSEP-KONSEP SEL VOLTA
Sel Volta
1. Deret Volta/Nerst
a.
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn
Fe Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
b.Makin ke kanan, mudah direduksi sukar dioksidasi
Makin ke kiri, mudah dioksidasi sukar direduksi
2. Prinsip
1. Anoda terjadi reaksi oksidasi ; Katoda terjadi reaksi reduksi
2. Arus elektron : anoda ® katoda ; Arus listrik : katoda ® anoda
3. Jembatan garam: menyetimbangkan ion-ion dalam larutan
MACAM SEL VOLTA
1.Sel Kering atau Sel Leclance
= Katoda : Karbon
= Anoda :Zn
= Elektrolit : Campuran berupa pasta : MnO2 + NH4Cl + sedikit Air
2.Sel Aki
= Katoda: PbO2
= Anoda : Pb
= Elektrolit: Larutan H2SO4
= Sel sekunder
3.Sel Bahan Bakar
= Elektroda : Ni
= Elektrolit : Larutan KOH
= Bahan Bakar : H2 dan O2
4. Baterai Ni – Cd
= Katoda : NiO2 dengan sedikit air
= Anoda : Cd
belajar dan terus belajar ayo belajar kimia bersama
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
Label
- Eksponen Hidrogen (7)
- Gas Hidrogen (2)
- gas mulia (1)
- Hasil Kali Kelarutan (3)
- Hidrokarbon (9)
- Hitungan kimia (1)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
- Kimia lingkungan (1)
- Kimia Terapan Dan Terpakai (1)
- Larutan (2)
- Reaksi kimia (1)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistem Periodik Unsur-Unsur (1)
- Sistim koloid (4)
- Soal-soal kimia (1)
- Stoikiometri (4)
- Struktur Atom (5)
- Teori Asam-Basa Dan Stokiometri Larutan (2)
- Termokimia (4)
- Tokoh Penemu ilmu dan hukum kimia (1)
- Unsur-Unsur Alkali (3)
- Unsur-Unsur Alkali tanah (4)
- Unsur-unsur halogen (3)
- Unsur-Unsur Periode Ketiga (1)
- Unsur-Unsur Transisi Periode Keempat (4)
- Video (2)
- Zat Radioaktif (2)
Arsip Blog
-
▼
2012
(68)
-
▼
Januari
(68)
- Gas Hidrogen : Pembuatan
- Gas Hidrogen : Sifat Fisika Dan Kimia
- Unsur-Unsur Transisi Dan Ion Kompleks
- Unsur-Unsur Periode Keempat : Sifat Reaksi Dari Se...
- Unsur-Unsur Transisi Periode Keempat : Sifat Periodik
- Pengertian Unsur Transisi
- Unsur-Unsur Periode Ketiga : Sifat-Sifat Periodik,...
- Unsur-Unsur Alkali Tanah : Kesadahan
- Kelarutan Unsur Alkali Tanah
- Sifat Fisika Dan Kimia Unsur Alkali Tanah
- Unsur-Unsur Alkali Tanah : Sifat Golongan Unsur Al...
- Unsur-Unsur Alkali : Pembuatan Logam Alkali
- Unsur-Unsur Alkali : Sifat Fisika Dan Kimia
- Unsur-Unsur Alkali : Sifat Golongan Unsur Alkali
- Unsur-Unsur Halogen : Hidrogen, Klor, Brom Dan Iodium
- Sifat Fisika Dan Sifat Kimia Unsur Halogen
- Unsur-unsur halogen : Sifat-sifat halogen
- Unsur-unsur gas mulia
- Download soal-soal kimia
- Hidrokarbon : Beberapa Hidrokarbon lain
- Hidrokarbon : Alkuna
- Hidrokarbon : Alkena
- Tata Nama Alkana
- Hidrokarbon : Isomer Alkana
- Hidrokarbon : Alkana
- Klasifikasi hidrokarbon
- Hidrokarbon : Kekhasan Atom Karbon
- Hidrokarbon : Hidrokarbon Termasuk Senyawa Karbon
- Ikatan kimia : Bentuk Molekul
- Ikatan Kimia : Ikatan Logam, Ikatan Hidrogen Dan I...
- Ikatan Kimia : Ikatan Kovalen Koordinasi = Semipolar
- Ikatan Kimia : Ikatan Kovalen = Homopolar
- Ikatan Kimia : Ikatan Ion = Elektrovalen = Heterop...
- Ikatan Kimia : Peranan Elektron Dalam Ikatan Kimia
- Sistem Periodik Unsur-Unsur
- Struktur atom : Konfigurasi Elektron
- Struktur Atom : bilangan-bilangan kuantum
- Struktur Atom : Model Atom
- Struktur Atom
- Hukum Faraday
- Reaksi Redoks Dan Elektrokimia : Elektrolisis
- Reaksi Redoks Dan Elektrokimia : Sel Volta
- Reaksi Redoks Dan Elektrokimia : Korosi
- Reaksi Redoks Dan Elektrokimia : Potensial Elektroda
- Reaksi Redoks Dan Elektrokimia : Elektrokimia
- Reaksi Redoks Dan Elektrokimia : Penyetaraan Persa...
- Reaksi Redoks Dan Elektrokimia : Langkah-Langkah P...
- Reaksi Redoks Dan Elektrokimia : Konsep Bilangan O...
- Reaksi Redoks Dan Elektrokimia : Oksidasi Reduksi
- Hasil Kali Kelarutan : Mengendapkan Elektrolit
- Hasil Kali Kelarutan : Kelarutan
- Hasil Kali Kelarutan
- Sifat Koligatif Larutan Elektrolit
- Sifat Koligatif Larutan Non Elektrolit
- Penurunan titik beku dan tekanan osmotik
- Sifat Koligatif Larutan : Penurunan tekanan uap jenuh
- Reaksi kimia
- Sel Elektrokimia
- Kimia Terapan Dan Terpakai
- Kimia lingkungan
- Zat Radioaktif : Keradioaktifan Buatan, Rumus Dan ...
- Zat Radioaktif : Keradioaktifan Alam
- Teori Asam-Basa Dan Stokiometri Larutan : Stokiome...
- Teori Asam-Basa Dan Stokiometri Larutan : Teori As...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Hidrolisis
- Eksponen Hidrogen : Larutan buffer
-
▼
Januari
(68)
-
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
-
-
Label
- Eksponen Hidrogen (7)
- Hidrokarbon (9)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- Larutan (2)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistim koloid (4)
- Stoikiometri (4)
- Struktur Atom (5)
- Termokimia (4)
- Unsur-Unsur Alkali tanah (4)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
Copyright © 2011 ILMU KIMIA | Powered by Blogger












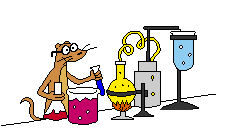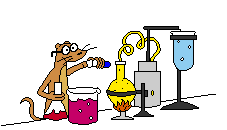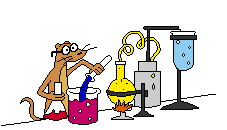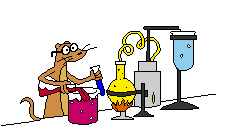
0 komentar:
Posting Komentar