PENURUNAN TITIK BEKU
Untuk penurunan titik beku persamaannya dinyatakan sebagai :
DTf = m . Kf = W/Mr . 1000/p . Kf
dimana:
DTf = penurunan titik beku
m = molalitas larutan
Kf = tetapan penurunan titik beku molal
W = massa zat terlarut
Mr = massa molekul relatif zat terlarut
p = massa pelarut
Apabila pelarutnya air dan tekanan udara 1 atm, maka titik beku larutannya dinyatakan sebagai:
Tf = (O – DTf)oC
Adanya zat terlarut dalam larutan akan mengakibatkan titik beku
larutan lebih kecil daripada titik beku pelarutnya. Persamaannya dapat
ditulis sebagai berikut[5] :

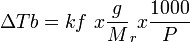
ΔTf = Tfpelarut − Tblarutan
- Keterangan :
kf = penurunan titik beku molal
m = massa zat terlarut
Mr = massa molekul relatif
Tabel Penurunan Titik Beku (Kf) Beberapa Pelarut[5]
| Pelarut | Titik Beku | Tetapan (Kf) |
|---|---|---|
| Aseton | -95,35 | 2,40 |
| Benzena | 5,45 | 5,12 |
| Kamfer | 179,8 | 39,7 |
| Karbon tetraklorida | -23 | 29,8 |
| Sikloheksana | 6,5 | 20,1 |
| Naftalena | 80,5 | 6,94 |
| Fenol | 43 | 7,27 |
| Air | 0 | 1,86 |
Tekanan osmotik adalah tekanan yang diberikan pada larutan yang dapat menghentikan perpindahan molekul-molekul pelarut ke dalam larutan melalui membran semi permeabel (proses osmosis).
Menurut VAN’T HOFF tekanan osmotik mengikuti hukum gas ideal:
PV = nRT
Karena tekanan osmotik = p , maka :
p = n/V R T = C R T
dimana :
p = tekanan osmotik (atmosfir)
C = konsentrasi larutan (mol/liter= M)
R = tetapan gas universal = 0.082 liter.atm/moloK
T = suhu mutlak (oK)
- Larutan yang mempunyai tekanan osmotik lebih rendah dari yang lain
disebut larutan Hipotonis.
- Larutan yang mempunyai tekanan osmotik lebih tinggi dari yang lain
disebut larutan Hipertonis.
- Larutan-larutan yang mempunyai tekanan osmotik sama disebut
Isotonis.















0 komentar:
Posting Komentar