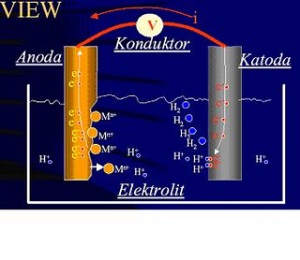
Pada peristiwa korosi, logam mengalami
oksidasi, sedangkan oksigen (udara) mengalami reduksi. Karat logam
umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi
adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat-merah.
Korosi adalah kerusakan atau degradasi logam akibat
reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya
yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa
sehari-hari, korosi disebut perkaratan. Contoh korosi yang paling lazim
adalah perkaratan besi.
Korosi merupakan proses elektrokimia. Pada korosi besi, bagian
tertentu dari besi itu berlaku sebagai anode, di mana besi mengalami
oksidasi.
Fe(s) <–> Fe2+(aq) + 2e
Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi
itu yang bertindak sebagai katode, di mana oksigen tereduksi.
O2(g) + 4H+(aq) + 4e <–> 2H2O(l)
atau
O2(g) + 2H2O(l) + 4e <–> 4OH-(aq)
Ion besi(II) yang terbentuk pada anode selanjutnya teroksidasi
membentuk ion besi(III) yang kemudian membentuk senyawa oksida
terhidrasi, yaitu karat besi. Mengenai bagian mana dari besi itu yang
bertindak sebagai anode dan bagian mana yang bertindak sebagai katode,
bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan
rapatan logam itu.
Korosi dapat juga diartikan sebagai serangan yang merusak logam
karena logam bereaksi secara kimia atau elektrokimia dengan lingkungan.
Ada definisi lain yang mengatakan bahwa korosi adalah kebalikan dari
proses ekstraksi logam dari bijih mineralnya. Contohnya, bijih mineral
logam besi di alam bebas ada dalam bentuk senyawa besi oksida atau besi
sulfida, setelah diekstraksi dan diolah, akan dihasilkan besi yang
digunakan untuk pembuatan baja atau baja paduan. Selama pemakaian, baja
tersebut akan bereaksi dengan lingkungan yang menyebabkan korosi
(kembali menjadi senyawa besi oksida).
Deret Volta dan hukum Nernst akan membantu untuk dapat mengetahui
kemungkinan terjadinya korosi. Kecepatan korosi sangat tergantung pada
banyak faktor, seperti ada atau tidaknya lapisan oksida, karena lapisan
oksida dapat menghalangi beda potensial terhadap elektroda lainnya yang
akan sangat berbeda bila masih bersih dari oksida.
KOROSI
1. Prinsip
Proses Elektrokimia
Proses Oksidasi Logam
2. Reaksi perkaratan besi
a.
Anoda: Fe(s) ® Fe2+ + 2e
Katoda: 2 H+ + 2 e- ® H2
2 H2O + O2 + 4e- ® 4OH-
b.
2H+ + 2 H2O + O2 + 3 Fe ® 3 Fe2+ + 4 OH- + H2
Fe(OH)2 oleh O2 di udara dioksidasi menjadi Fe2O3 . nH2O
3.Faktor yang berpengaruh
1. Kelembaban udara
2. Elektrolit
3. Zat terlarut pembentuk asam (CO2, SO2)
4. Adanya O2
5. Lapisan pada permukaan logam
6. Letak logam dalam deret potensial reduksi
4.Mencegah Korosi
1. Dicat
2. Dilapisi logam yang lebih mulia
3. Dilapisi logam yang lebih mudah teroksidasi
4. Menanam batang-batang logam yang lebih aktif dekat logam besi dan dihubungkan
5. Dicampur dengan logam lain
belajar dan terus belajar ayo belajar kimia bersama
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
Label
- Eksponen Hidrogen (7)
- Gas Hidrogen (2)
- gas mulia (1)
- Hasil Kali Kelarutan (3)
- Hidrokarbon (9)
- Hitungan kimia (1)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
- Kimia lingkungan (1)
- Kimia Terapan Dan Terpakai (1)
- Larutan (2)
- Reaksi kimia (1)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistem Periodik Unsur-Unsur (1)
- Sistim koloid (4)
- Soal-soal kimia (1)
- Stoikiometri (4)
- Struktur Atom (5)
- Teori Asam-Basa Dan Stokiometri Larutan (2)
- Termokimia (4)
- Tokoh Penemu ilmu dan hukum kimia (1)
- Unsur-Unsur Alkali (3)
- Unsur-Unsur Alkali tanah (4)
- Unsur-unsur halogen (3)
- Unsur-Unsur Periode Ketiga (1)
- Unsur-Unsur Transisi Periode Keempat (4)
- Video (2)
- Zat Radioaktif (2)
Arsip Blog
-
▼
2012
(68)
-
▼
Januari
(68)
- Gas Hidrogen : Pembuatan
- Gas Hidrogen : Sifat Fisika Dan Kimia
- Unsur-Unsur Transisi Dan Ion Kompleks
- Unsur-Unsur Periode Keempat : Sifat Reaksi Dari Se...
- Unsur-Unsur Transisi Periode Keempat : Sifat Periodik
- Pengertian Unsur Transisi
- Unsur-Unsur Periode Ketiga : Sifat-Sifat Periodik,...
- Unsur-Unsur Alkali Tanah : Kesadahan
- Kelarutan Unsur Alkali Tanah
- Sifat Fisika Dan Kimia Unsur Alkali Tanah
- Unsur-Unsur Alkali Tanah : Sifat Golongan Unsur Al...
- Unsur-Unsur Alkali : Pembuatan Logam Alkali
- Unsur-Unsur Alkali : Sifat Fisika Dan Kimia
- Unsur-Unsur Alkali : Sifat Golongan Unsur Alkali
- Unsur-Unsur Halogen : Hidrogen, Klor, Brom Dan Iodium
- Sifat Fisika Dan Sifat Kimia Unsur Halogen
- Unsur-unsur halogen : Sifat-sifat halogen
- Unsur-unsur gas mulia
- Download soal-soal kimia
- Hidrokarbon : Beberapa Hidrokarbon lain
- Hidrokarbon : Alkuna
- Hidrokarbon : Alkena
- Tata Nama Alkana
- Hidrokarbon : Isomer Alkana
- Hidrokarbon : Alkana
- Klasifikasi hidrokarbon
- Hidrokarbon : Kekhasan Atom Karbon
- Hidrokarbon : Hidrokarbon Termasuk Senyawa Karbon
- Ikatan kimia : Bentuk Molekul
- Ikatan Kimia : Ikatan Logam, Ikatan Hidrogen Dan I...
- Ikatan Kimia : Ikatan Kovalen Koordinasi = Semipolar
- Ikatan Kimia : Ikatan Kovalen = Homopolar
- Ikatan Kimia : Ikatan Ion = Elektrovalen = Heterop...
- Ikatan Kimia : Peranan Elektron Dalam Ikatan Kimia
- Sistem Periodik Unsur-Unsur
- Struktur atom : Konfigurasi Elektron
- Struktur Atom : bilangan-bilangan kuantum
- Struktur Atom : Model Atom
- Struktur Atom
- Hukum Faraday
- Reaksi Redoks Dan Elektrokimia : Elektrolisis
- Reaksi Redoks Dan Elektrokimia : Sel Volta
- Reaksi Redoks Dan Elektrokimia : Korosi
- Reaksi Redoks Dan Elektrokimia : Potensial Elektroda
- Reaksi Redoks Dan Elektrokimia : Elektrokimia
- Reaksi Redoks Dan Elektrokimia : Penyetaraan Persa...
- Reaksi Redoks Dan Elektrokimia : Langkah-Langkah P...
- Reaksi Redoks Dan Elektrokimia : Konsep Bilangan O...
- Reaksi Redoks Dan Elektrokimia : Oksidasi Reduksi
- Hasil Kali Kelarutan : Mengendapkan Elektrolit
- Hasil Kali Kelarutan : Kelarutan
- Hasil Kali Kelarutan
- Sifat Koligatif Larutan Elektrolit
- Sifat Koligatif Larutan Non Elektrolit
- Penurunan titik beku dan tekanan osmotik
- Sifat Koligatif Larutan : Penurunan tekanan uap jenuh
- Reaksi kimia
- Sel Elektrokimia
- Kimia Terapan Dan Terpakai
- Kimia lingkungan
- Zat Radioaktif : Keradioaktifan Buatan, Rumus Dan ...
- Zat Radioaktif : Keradioaktifan Alam
- Teori Asam-Basa Dan Stokiometri Larutan : Stokiome...
- Teori Asam-Basa Dan Stokiometri Larutan : Teori As...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Hidrolisis
- Eksponen Hidrogen : Larutan buffer
-
▼
Januari
(68)
-
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
-
-
Label
- Eksponen Hidrogen (7)
- Hidrokarbon (9)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- Larutan (2)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistim koloid (4)
- Stoikiometri (4)
- Struktur Atom (5)
- Termokimia (4)
- Unsur-Unsur Alkali tanah (4)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
Copyright © 2011 ILMU KIMIA | Powered by Blogger















0 komentar:
Posting Komentar