
Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikatakan sebagai reduktif dan dikenal sebagai reduktor atau agen reduksi.
Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri
teroksidasi. Oleh karena ia “mendonorkan” elektronnya, ia juga disebut
sebagai penderma elektron. Senyawa-senyawa yang berupa reduktor sangat
bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat
digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah reagen transfer hidrida, misalnya NaBH4 dan LiAlH4), reagen-reagen ini digunakan dengan luas dalam kimia organik[1][2],
terutama dalam reduksi senyawa-senyawa karbonil menjadi alkohol. Metode
reduksi lainnya yang juga berguna melibatkan gas hidrogen (H2) dengan katalis paladium, platinum, atau nikel, Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor
mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor
melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron
dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam
sebuah reaksi disebut sebagai pasangan redoks.
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidatif dan dikenal sebagai oksidator atau agen oksidasi.
Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya
sendiri tereduksi. Oleh karena ia “menerima” elektron, ia juga disebut
sebagai penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang
memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4)
atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat
mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah
senyawa (misalnya oksigen, fluorin, klorin, dan bromin).
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:



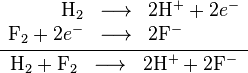















0 komentar:
Posting Komentar