Istilah atom berasal dari Bahasa Yunani,
yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat
dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat
dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan
Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar
pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat
dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama
akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan
struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa
‘atom’ tidaklah tak dapat dibagi-bagi lagi.Prinsip-prinsip mekanika
kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom.
Relatif terhadap pengamatan sehari-hari, atom merupakan objek yang
sangat kecil dengan massa yang sama kecilnya pula. Atom hanya dapat
dipantau menggunakan peralatan khusus seperti mikroskop penerowongan
payaran. Lebih dari 99,9% massa atom berpusat pada inti atom, dengan
proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak
memiliki satu isotop dengan inti yang tidak stabil yang dapat mengalami
peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi yang
mengubah jumlah proton dan neutron pada inti. Elektron yang terikat pada
atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan
dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun
memancarkan foton yang sesuai dengan perbedaan energi antara aras.
Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur dan
memengaruhi sifat-sifat magnetis atom tersebut.
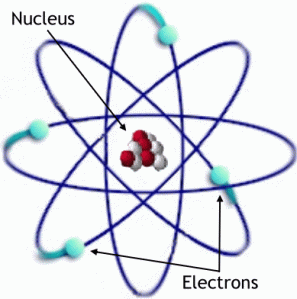
Struktur atom merupakan satuan dasar materi yang
terdiri dari inti atom beserta awan elektron bermuatan negatif yang
mengelilinginya.Inti atom mengandung campuran proton yang bermuatan
positif dan neutron yang bermuatan netral (terkecuali pada Hidrogen-1
yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat
pada inti atom oleh gaya elektromagnetik. Demikian pula sekumpulan atom
dapat berikatan satu sama lainnya membentuk sebuah molekul. Atom yang
mengandung jumlah proton dan elektron yang sama bersifat netral,
sedangkan yang mengandung jumlah proton dan elektron yang berbeda
bersifat positif atau negatif dan merupakan ion. Atom dikelompokkan
berdasarkan jumlah proton dan neutron pada inti atom tersebut. Jumlah
proton pada atom menentukan unsur kimia atom tersebut, dan jumlah
neutron menentukan isotop unsur tersebut.
a. Partikel dasar : partikel-partikel pembentuk atom yang terdiri dari elektron, proton den neutron.
1. Proton : partikel pembentuk atom yang mempunyai massa sama dengan satu sma (amu) dan bermuatan +1.
2. Neutron : partikel pembentuk atom yang bermassa satu sma (amu) dan netral.
3. Elektron : partikel pembentuk atom yang tidak mempunyai massa dan bermuatan -1.
b. Nukleus : Inti atom yang bermuatan positif, terdiri dari proton den neutron.
c. Notasi unsur : zA A dengan X : tanda atom (unsur)
Z : nomor atom = jumlah elektron (e)
= jumlah proton (p)
A : bilangan massa = jumlah proton + neutron
Pada atom netral, berlaku: jumlah elektron = jumlah proton.
Contoh :
1. Tentukan jumlah elektron, proton den neutron dari unsur 2656 Fe !
Jawab :
Jumlah elektron = jumlah proton = nomor atom = 26
Jumlah neutron = bilangan massa – nomor atom = 56 – 26 = 30
2. Berikan notasi unsur X, jika diketahui jumlah neutron = 14 dan jumlah elektron = 13 !
Jawab :
Nomor atom = jumlah elektron = 13
Bilangan massa = jumlah proton + neutron = 13 + 14 = 27
Jadi notasi unsurnya: 13 27 X
d. Atom tak netral : atom yang bermuatan listrik karena kelebihan
atau kekurangan elektron bila dibandingkan dengan atom netralnya.
Atom bermuatan positif bila kekurangan elektron, disebut kation.
Atom bermuatan negatif bila kelebihan elektron, disebut anion.
Contoh:
- Na+ : kation dengan kekurangan 1 elektron
- Mg2- : kation dengan kekurangan 2 elektron
- Cl- : anion dengan kelebihan 1 elektron
- O2 : anion dengan kelebihan 2 elektron
e. Isotop : unsur yang nomor atomnya sama, tetapi berbeda bilangan massanya.
Contoh: Isotop oksigen: 816 O ; 817 O ; 818 O
f. Isobar : unsur yang bilangan massanya sama, tetapi berbeda nomor atomnya.
Contoh: 2759 CO dengan 2859 Ni
g. Isoton : unsur dengan jumlah neutron yang sama.
Contoh: 613 C dengan 714 N
h. Iso elektron: atom/ion dengan jumlah elektron yang sama.
Contoh: Na+ dengan Mg2+
K+ dengan Ar
belajar dan terus belajar ayo belajar kimia bersama
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
Label
- Eksponen Hidrogen (7)
- Gas Hidrogen (2)
- gas mulia (1)
- Hasil Kali Kelarutan (3)
- Hidrokarbon (9)
- Hitungan kimia (1)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
- Kimia lingkungan (1)
- Kimia Terapan Dan Terpakai (1)
- Larutan (2)
- Reaksi kimia (1)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistem Periodik Unsur-Unsur (1)
- Sistim koloid (4)
- Soal-soal kimia (1)
- Stoikiometri (4)
- Struktur Atom (5)
- Teori Asam-Basa Dan Stokiometri Larutan (2)
- Termokimia (4)
- Tokoh Penemu ilmu dan hukum kimia (1)
- Unsur-Unsur Alkali (3)
- Unsur-Unsur Alkali tanah (4)
- Unsur-unsur halogen (3)
- Unsur-Unsur Periode Ketiga (1)
- Unsur-Unsur Transisi Periode Keempat (4)
- Video (2)
- Zat Radioaktif (2)
Arsip Blog
-
▼
2012
(68)
-
▼
Januari
(68)
- Gas Hidrogen : Pembuatan
- Gas Hidrogen : Sifat Fisika Dan Kimia
- Unsur-Unsur Transisi Dan Ion Kompleks
- Unsur-Unsur Periode Keempat : Sifat Reaksi Dari Se...
- Unsur-Unsur Transisi Periode Keempat : Sifat Periodik
- Pengertian Unsur Transisi
- Unsur-Unsur Periode Ketiga : Sifat-Sifat Periodik,...
- Unsur-Unsur Alkali Tanah : Kesadahan
- Kelarutan Unsur Alkali Tanah
- Sifat Fisika Dan Kimia Unsur Alkali Tanah
- Unsur-Unsur Alkali Tanah : Sifat Golongan Unsur Al...
- Unsur-Unsur Alkali : Pembuatan Logam Alkali
- Unsur-Unsur Alkali : Sifat Fisika Dan Kimia
- Unsur-Unsur Alkali : Sifat Golongan Unsur Alkali
- Unsur-Unsur Halogen : Hidrogen, Klor, Brom Dan Iodium
- Sifat Fisika Dan Sifat Kimia Unsur Halogen
- Unsur-unsur halogen : Sifat-sifat halogen
- Unsur-unsur gas mulia
- Download soal-soal kimia
- Hidrokarbon : Beberapa Hidrokarbon lain
- Hidrokarbon : Alkuna
- Hidrokarbon : Alkena
- Tata Nama Alkana
- Hidrokarbon : Isomer Alkana
- Hidrokarbon : Alkana
- Klasifikasi hidrokarbon
- Hidrokarbon : Kekhasan Atom Karbon
- Hidrokarbon : Hidrokarbon Termasuk Senyawa Karbon
- Ikatan kimia : Bentuk Molekul
- Ikatan Kimia : Ikatan Logam, Ikatan Hidrogen Dan I...
- Ikatan Kimia : Ikatan Kovalen Koordinasi = Semipolar
- Ikatan Kimia : Ikatan Kovalen = Homopolar
- Ikatan Kimia : Ikatan Ion = Elektrovalen = Heterop...
- Ikatan Kimia : Peranan Elektron Dalam Ikatan Kimia
- Sistem Periodik Unsur-Unsur
- Struktur atom : Konfigurasi Elektron
- Struktur Atom : bilangan-bilangan kuantum
- Struktur Atom : Model Atom
- Struktur Atom
- Hukum Faraday
- Reaksi Redoks Dan Elektrokimia : Elektrolisis
- Reaksi Redoks Dan Elektrokimia : Sel Volta
- Reaksi Redoks Dan Elektrokimia : Korosi
- Reaksi Redoks Dan Elektrokimia : Potensial Elektroda
- Reaksi Redoks Dan Elektrokimia : Elektrokimia
- Reaksi Redoks Dan Elektrokimia : Penyetaraan Persa...
- Reaksi Redoks Dan Elektrokimia : Langkah-Langkah P...
- Reaksi Redoks Dan Elektrokimia : Konsep Bilangan O...
- Reaksi Redoks Dan Elektrokimia : Oksidasi Reduksi
- Hasil Kali Kelarutan : Mengendapkan Elektrolit
- Hasil Kali Kelarutan : Kelarutan
- Hasil Kali Kelarutan
- Sifat Koligatif Larutan Elektrolit
- Sifat Koligatif Larutan Non Elektrolit
- Penurunan titik beku dan tekanan osmotik
- Sifat Koligatif Larutan : Penurunan tekanan uap jenuh
- Reaksi kimia
- Sel Elektrokimia
- Kimia Terapan Dan Terpakai
- Kimia lingkungan
- Zat Radioaktif : Keradioaktifan Buatan, Rumus Dan ...
- Zat Radioaktif : Keradioaktifan Alam
- Teori Asam-Basa Dan Stokiometri Larutan : Stokiome...
- Teori Asam-Basa Dan Stokiometri Larutan : Teori As...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Garam Yang Terbentuk Dari Asam...
- Eksponen Hidrogen : Hidrolisis
- Eksponen Hidrogen : Larutan buffer
-
▼
Januari
(68)
-
Entri Populer
-
Dalam bentuk molekul dikenal adanya teori ikatan valensi. Teori ini menyatakan bahwa ikatan antar atom terjadi dengan cara saling bertin...
-
Sifat – Sifat Halogen X 2 Fluor (F 2 ) Klor (Cl 2 ) Brom (Br 2 ) Iodium (I 2 ) 1. Molekulnya Diatom 2. Wu...
-
Kalsium, stronsium, barium, dan radium membentuk senyawa ion bermuatan +2. Magnesium kadang-kadang bersifat kovalen dan berilium lebih d...
-
Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Sebagai c...
-
Pada tahun 1808, Marie Francois Raoult seorang kimiawan asal Perancis melakukan percobaan mengenai tekanan uap jenuh larutan, sehingga i...
-
-
Label
- Eksponen Hidrogen (7)
- Hidrokarbon (9)
- Ikatan Kimia (6)
- Kecepatan Reaksi (5)
- Kesetimbangan kimia (6)
- Kimia kelas 1 (24)
- Larutan (2)
- Reaksi Redoks Dan Elektrokimia (10)
- Sel Elektrokimia (1)
- Sifat Koligatif Larutan (4)
- Sistim koloid (4)
- Stoikiometri (4)
- Struktur Atom (5)
- Termokimia (4)
- Unsur-Unsur Alkali tanah (4)
- kimia kelas 2 (51)
- kimia kelas 3 (18)
Copyright © 2011 ILMU KIMIA | Powered by Blogger















0 komentar:
Posting Komentar